সমোষ্ণ এবং রুদ্ধতাপীয় প্রক্রিয়ার ব্যাখ্যা – পদার্থবিজ্ঞান পদার্থ ও তার গতির বিজ্ঞান। বাংলায় “পদার্থবিজ্ঞান” শব্দটি একটি সমাসবদ্ধ পদ। “পদার্থ” ও “বিজ্ঞান” দুটি সংস্কৃত শব্দ নিয়ে এটি গঠিত। এর ইংরেজি পরিভাষা Physics শব্দটি গ্রিক φύσις (ফুঁসিস) অর্থাৎ “প্রকৃতি”, এবং φυσικῆ (ফুঁসিকে) অর্থাৎ “প্রকৃতি সম্পর্কিত জ্ঞান” থেকে এসেছে। পদার্থবিজ্ঞান বলতে বলা যেতে পারে এটা হলো গণিতের বাস্তব রূপ।
সমোষ্ণ এবং রুদ্ধতাপীয় প্রক্রিয়ার ব্যাখ্যা
যে প্রক্রিয়ায় গ্যাসের চাপ ও আয়তন পরিবর্তিত হয় কিন্তু তাপমাত্রার পরিবর্তন হয় না তাকে নামার প্রক্রিয়া चগা হয় এবং এই মরনের পরিবর্তনকে সমোষ্ণ পরিবর্তন বলা হয়। কোনো থাকে প্রয়োগ করে সংকুচিত করলে গ্যাসের তাপমাত্রা বেড়ে যাবে। অন্যদিকে গ্যাসকে হঠাৎ জাতি তে দিলে গ্যাসের তাপমাত্রা কমে যাবে। যদি আস্তে আস্তে চাপের পরিবর্তন করা হয় এবং সংকোচনের সময় সময় তাপ প্রদান করে তাপমাত্রা স্থির রাখা হয়, তবে সেই পরিবর্তনকে সময় সমানমো পরিবর্তনে চাপ ও আয়তনের পরস্পরের সম্পর্ক রয়েলের থেকে পাওয়া যায়।
PV = ধ্রুবক । মুজ সমোষ্ণ প্রক্রিয়ায় অভ্যস্থ শক্তি অপরিবর্তিত থাকে, অর্থাৎ A = 0 তাপগতিবিদ্যার প্রথম সূত্র (ii) নং থেকে পাওয়া যায়—
Ti>Ta
do = dw অমোক প্রক্রিয়ায় গ্যাসের চাপ ও আয়তনের সাথে সম্পর্কিত বয়েলের সূত্র মেনে চলে অর্থাৎ, PV = ধ্রুবক। স্থির তাপমাত্রায় X-অক্ষে আয়তন (V) এবং Y-অক্ষে চাপ (P) কে স্থাপন করলে চিত্রের মতো rectangular hyperbola হবে, যাদেরকে সমো শেখ বলে।
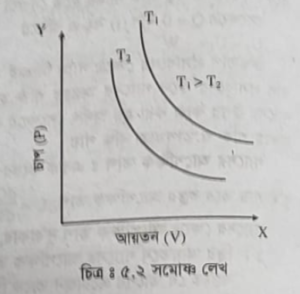
সমোষ্ণ প্রক্রিয়ার শর্তসমূহ নিম্নরূপ-
১। চাপের পরিবর্তন ধীরে ধীরে হতে হবে।
২। তাপ গ্রহণ বা তাণ বর্জনের সময় তাপমাত্রা স্থির থাকে
৩। গ্যাসকে সুপরিবাহী পাত্রে রাখতে হবে।
৪। পরিবেশের তাপ ধারণ ক্ষমতা উচ্চ হতে হবে।
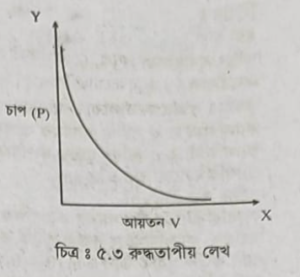
২। রুদ্ধতাপীয় প্রক্রিয়া (Adiabatie process) ঃ যে প্রক্রিয়ায় বস্তুর চাপ ও আয়তনের পরিবর্তন হয় কিন্তু প্রক্রিয়াধীন বন্ধু তাপ গ্রহণ বা বর্জ্জন করতে পারে না সেই প্রক্রিয়াকে রুদ্ধতাপীয় প্রক্রিয়া এবং এই পরিবর্তনকে রুদ্ধতাপীয় পরিবর্তন বলে।
রুদ্ধতাপীয় প্রক্রিয়ায় গ্যাসকে সংকুচিত করলে তাপমাত্রা বাড়ে এবং প্রসারিত করলে তাপমাত্রা কমে। অর্থাৎ রুদ্ধতাপীয় প্রক্রিয়ায়, d = 0
সেক্ষেত্রে তাপ গতিবিদ্যার ১ম সূত্র (ii) নং সমীকরণ থেকে
dU=-dw
রুদ্ধতাপীয় প্রক্রিয়ার বৈশিষ্ট্য :
১। চাপ খুবই দ্রুত পরিবর্তন ঘটাতে হবে যাতে বাইরে আদান-প্রদানের সুযোগ না থাকে ।
২.পরিবেশের তাপ ধারণ ক্ষমতা কম হবে।
৩. গ্যাস কুপরিবাহী পাত্রে রাখতে হবে।
৩। ধ্রুব আয়তন প্রক্রিয়া (Isochoric process ) : যে প্রক্রিয়ায় বস্তুর আয়তন অপরিবর্তিত থাকে কিন্তু চাপ ও তাপমাত্রা পরিবর্তন হয় তাকে ধ্রুব আয়তন প্রক্রিয়া বলে। এখানে আয়তন পরিবর্তন AV = 0. বহিস্থ কাজের পারমাণ, dW = PV = 0 ফলে প্রথম সূত্র থেকে পাই,
dQ = du
অর্থাৎ এক্ষেত্রে শোষিত তাপের সবটুকু অন্তঃস্থ শক্তি পরিবর্তনে ব্যয় হয়।
৪। ধ্রুব চাপ প্রক্রিয়া (Isobaric process) : যে প্রক্রিয়ায় চাপ ধ্রুব রাখা হয় সেই প্রক্রিয়াকে ধ্রুব চাপ প্রক্রিয়া বলে । এই ক্ষেত্রে শোষিত তাপ dQ এর কিছু অংশ অন্তঃস্থ শক্তি পরিবর্তনে এবং বাকি অংশ বহিস্থ কাজ সম্পাদনে ব্যয় হয়।
dQ = dU + dW
বা, dQ = 02 – U1 + P (V2 – V1)
এখানে, U2 = চূড়ান্ত অন্তঃস্থ শক্তি, U = প্রাথমিক অন্তঃস্থ শক্তি
V2 = চূড়ান্ত আয়তন, V = প্রাথমিক আয়তন
dQ = (U2 + PV2) – (U1 + PV) =H₂-H₁
এখানে, H = U + PV কে এনথালপি বলা হয়। কোনো সিস্টেমের অন্তঃস্থ শক্তি U এর সাথে PV যোগ করলে যে শক্তি হয়, তাকে সিস্টেমের এনথালপি বা ধৃত তাপ বলে ।
ধ্রুব চাপে শোষিত তাপ বস্তুর এনথালপির পরিবর্তনের সমান। H কে মোট তাপ (Total heat or heat content) বলা হয় ।
জুলের ক্যালরিমিটারের সাহায্যে J এর মান নির্ণয় ঃ
তত্ত্ব ঃ যদি কোনো পরিবাহীর দু’প্রান্তের বিভব পার্থক্য V volt হয় এর মধ্য দিয়ে যদি I amp তাড়ৎ প্রবাহ t sec ধরে চলে তাহলে প্রবাহ কতৃক কৃত কাজের পরিমাণ হবে-
W = VIt Joule
যদি এই কাজ সম্পূর্ণভাবে তাপ শক্তিতে রূপান্তরিত হয় এবং তাপের পরিমাণ হয় H cal তাহলে, W = JH
বা, JH = VIt
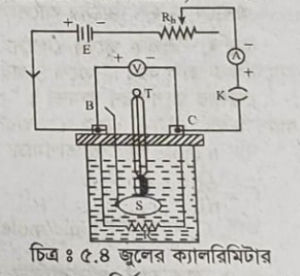
কার্যপ্রণালি ঃ নাড়ানিসহ একটি জুলের ক্যালরিমিটার ধুয়ে শুকিয়ে নিক্তির সাহায্যে এর ভর নির্ণয় করা হয়। এবার এতে কিছু পানি দিয়ে পুনরায় ভর নির্ণয় করা হয় এবং দ্বিতীয় ভর থেকে প্রথম থার্মোমিটারের (T) সাহায্যে পানির প্রাথমিক তাপমাত্রা নির্ণয় করা হয় । R রোধ বিশিষ্ট ক্যালরিমিটারের কুণ্ডলীকে একটি ব্যাটারি B, পরিবর্তনশীল রোধ Rh, অ্যামিটার A ও চাবি K-এর সাথে শ্রেণি সমবায়ে যুক্ত করা হয়। কুণ্ডলীর দু’প্রান্তের বিভব পার্থক্য নির্ণয়ের জন্য একটি ভোল্টমিটার V কে কুণ্ডলীর সাথে সমান্তরালে যুক্ত করা হয়।
চাবি বন্ধ করে একটি নির্দিষ্ট সময় ধরে বর্তনীর মধ্য দিয়ে তড়িৎ প্রবাহিত করা হয় এবং অ্যামিটার ও ভোল্টমিটারের পাঠ রাখা হয়। বর্তনীতে কত সময় ধরে তড়িৎ প্রবাহ চালানো হয়েছে তা থামা ঘড়ির (Stop watch) সাহায্যে পরিমাপ করা হয়। পরীক্ষা চলার সময় নাড়ানির সাহায্যে তরল পদার্থটিকে সবসময় ধীরে ধীরে নাড়ানো হয়। থার্মোমিটারের সাহায্যে তরলের চূড়ান্ত তাপমাত্রা নির্ণয় করা হয়।
হিসাব :
ধরা যাক,
তড়িৎ প্রবাহমাত্রা = I amp
কুণ্ডলীর দু’প্রান্তের পার্থক্য = V volt
প্রবাহকাল = t sec ক্যালরিমিটার ও পানির প্রাথমিক তাপমাত্রা = 01 ক্যালরিমিটার ও পানির চূড়ান্ত তাপমাত্রা = 02
ক্যালরিমিটারের ভর = Mgm পানির ভর = m gm
ক্যালরিমিটারের উপাদানের আপেক্ষিক তাপ = S
অতএব, ক্যালরিমিটার কর্তৃক গৃহীত তাপ = M S (02 – 01) cal,
পানি কর্তৃক গৃহীত তাপ = m (02 – 01) cal [পানির জন্য S = 1]
মোট গৃহীত তাপ, H = MS (02 – 01 ) + m (02 – 1) cal
= (MS + m) (02 – 01) cal
আমরা জানি, J = VIt H
VIt J/cal
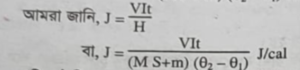
পরিবর্তনশীল রোধের মান পরিবর্তন করে বিভিন্ন প্রবাহমাত্রা বিভিন্ন সময় ধরে চালনা করে J-এর মান নির্ণয় করা যায়।

2 thoughts on “সমোষ্ণ এবং রুদ্ধতাপীয় প্রক্রিয়ার ব্যাখ্যা | তাপের প্রকৃতি ও এর যান্ত্রিক সমতা | পদার্থবিজ্ঞান”