আজকে আমরা পরমাণু গঠনের ক্রম বিকাশ সম্পর্কে আলোচনা করবো। যা বাউবি এইচএসসি ২৮৭১ পদার্থ বিজ্ঞান ২য় পত্র ইউনিট ৯ নিউক্লিয় পদার্থবিজ্ঞান এর অন্তর্ভুক্ত।

পরমাণু গঠনের ক্রম বিকাশ
বহু প্রাচীন কালে ভারতীয় দার্শনিক কণাদ বলেছিলেন, পদার্থ কতকগুলি ক্ষুদ্র ক্ষুদ্র কণা দিয়ে গঠিত। গ্রীক দার্শনিক ডেমোক্রিটাস (Democritus) এবং আরো অনেক তৎ-সমসাময়িক বিজ্ঞানীগণ বলেন পদার্থ মাত্রই বিচ্ছিন্ন কণা দিয়ে তৈরি এবং এই কণাগুলো অবিভাজ্য। গ্রীক ভাষায় ‘অ্যাটম (Atom) শব্দের অর্থ অবিভাজ্য। সেজন্য পদার্থের এই ক্ষুদ্রতম কণাগুলি অ্যাটম (Atom) বা পরমাণু নামে অভিহিত করা হয়। তবে এই সব ধারণাগুলো ছিল কল্পনা প্রসূত। ঊনবিংশ শতাব্দীর প্রথম ভাগে বিজ্ঞানী জন ডালটন (John Dalton) রাসায়নিক সংযোগসূত্রগুলো ব্যাখ্যা করার জন্য একটি তত্ত্ব উপস্থাপন করেন। সেটি ডালটনের পারমাণবিক তত্ত্ব নামে পরিচিত। ডালটনের তত্ত্বানুসারে,
১। সকল মৌলিক পদার্থ অতি সূক্ষ্ম, অবিভাজ্য নিরেট কণার সমন্বয়ে গঠিত। কণাগুলোকে বলা হয় পরমাণু ।
২। একই মৌলিক পদার্থের পরমাণুগুলো একই প্রকারের, কিন্তু বিভিন্ন মৌলিক পদার্থের পরমাণুগুলো বিভিন্ন।
৩। একাধিক পরমাণুর রাসায়নিক মিলনে যৌগিক পরমাণু সৃষ্টি করে।
পরমাণু সম্বন্ধে ধারণা জন্মের বহু পূর্বেই মানুষ স্থির তড়িতের ব্যবহার জেনেছে। সেখানে ধনাত্মক চার্জ এবং ঋণাত্মক চার্জের সন্ধান পেয়েছে। কিন্তু এর কারণ জানা ছিল না।
বায়ু তড়িৎ কুপরিবাহী। শূন্য মাধ্যমে তড়িৎ প্রবাহিত হয় কিনা তা জানার জন্য পরীক্ষা চালানো হলো। তড়িৎদ্বারে দুই প্রান্ত্ েউচ্চ বিভব রেখে তড়িৎ মোক্ষম নলের মধ্যে চাপ 102 mmHg মত করলে দেখা যায় ক্যাথোড থেকে এক জাতীয় অদৃশ্য রশ্মি নির্গত হয়ে নলের কাচে আপতিত হয়ে নীলাভ প্রতিপ্রভা সৃষ্টি করে। একে ক্যাথোড রশ্মি বলা হয়।
ঊনবিংশ শতাব্দীর শেষ দশকে উইলিয়াম ক্রুকস্ (William Crooke), জে, জে, থমসন (JJ. Thomson), ফিলিপ লেনার্ড (Phlip Lenard), মিলিক্যান (Millikan) ও অন্যান্য বিজ্ঞানীরা বিভিন্ন পরীক্ষার মাধ্যমে প্রমাণ করেন যে, এই অদৃশ্য রশ্মি প্রকৃত পক্ষে ক্যাথোড থেকে এবং এর পৃষ্ঠ থেকে লম্ব ভাবে নির্গত হয়ে উচ্চ বেগে গতিশীল এক প্রকার ঋণাত্মক চার্জ যুক্ত কণিকার স্রোত।
উপযুক্ত পরীক্ষার মাধ্যমে বিভিন্ন ধরনের পদার্থ থেকেই ইলেকট্রন নিঃসরণ ঘটানো সম্ভব। এর থেকে এটি প্রমাণিত হয় যে, মৌলের পরমাণুকে অবিভাজ্য কণা বলা চলে না এবং সব পরমাণুরই অন্যতম উপাদান হলো ইলেকট্রন। জে, জে, থমসনকেই ইলেকট্রনের আবিষ্কার কর্তা হিসাবে ধরা হয়। এরপর থেকে পরমাণুর অবিভাজ্যতার ভ্রান্ত্ ধারণার অবসান ঘটে।
ইলেকট্রন একটি মৌলিক কণা। এটি ঋণাত্মক চার্জগ্রস্থ। এর চার্জকে -e দিয়ে প্রকাশ করা হয়। থমসন তার পরীক্ষার সাহায্যে এই কণিকার চার্জ ও ভরের অনুপাত নির্ণয় করেন। এই কণিকার চার্জ ও ভরের অনুপাত -1.76×10″Ckg’পরীক্ষায় আরো প্রমাণিত হয় যে, এই কণিকাগুলোর ভরের মান এবং চার্জের মান সর্বদা একই থাকে। এর ভর 9.11×10-31 kg যা মোটামুটি হাইড্রোজেন পরমাণুর ভরের 1/1836 গুণ এবং চার্জ 1.6×10 C জে. জে. থমসনের পরীক্ষায় প্রমাণিত হলো যে, পরমাণুর চেয়ে হালকা কণিকা বিদ্যমান এবং এর চার্জ রয়েছে। সুতরাং পরমাণু অবিভাজ্য হতে পারে না এবং পরমাণু চার্জ নিরপেক্ষ হলেও চার্জহীন নয় ।
1897 সালে থমসন কর্তৃক ইলেকট্রন আবিস্কারের পর বিজ্ঞানীরা পরমাণু সম্পর্কে দুটি মতবাদ ব্যক্ত করেন :
১। প্রতিটি পরমাণুতে ইলেকট্রন বিদ্যমান, এবং
২। যেহেতু প্রতিটি পরমাণু বৈদ্যুতিকভাবে নিরপেক্ষ, সুতরাং এতে কিছু ধনাত্মক চার্জ আছে এবং এর চার্জ ইলেকট্রনগুলোর ঋণাত্মক চার্জের সমান হওয়া অত্যাবশ্যক । এখন স্বাভাবিক ভাবেই প্রশ্ন আসতে পারে যে, একটি পরমাণুতে কতগুলো ইলেকট্রন থাকতে পারে এবং পরমাণুর মধ্যে এ ধনাত্মক ও ঋণাত্মক চার্জগুলো কিভাবে অবস্থান করছে।
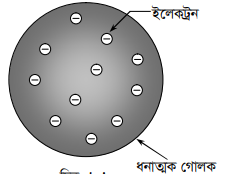
থমসনের পরমাণু মডেল :
ইলেকট্রন আবিস্কারের পরপরই থমসন পরমাণুর গঠন সম্পর্কে একটি মডেল উপস্থাপন করেন। তাঁর এ মডেল পণ্ডাম পুডিং মডেল নামে পরিচিত। তাঁর মতে পরমাণু একটি নিরেট ধনাত্মক গোলক এবং এই গোলকের মধ্যে বিক্ষিপ্তভাবে ইলেকট্রনগুলো ছড়ানো আছে (চিত্র ৯.১) ঠিক যেমন পুডিং এর মধ্যে কিসমিস ছড়ানো থাকে। তাই একে পন্টাম পুডিং মডেল বলা হয় ।
গোলকের ধনাত্মক চার্জ ইলেকট্রনগুলোর মোট ঋণাত্মক চার্জের সমান, তাই পরমাণু তড়িৎ নিরপেক্ষ। তিনি আরো উলেণ্ঢখ করেন যে, বিভিন্ন মৌলিক পদার্থে ইলেকট্রনের সংখ্যা বিভিন্ন। পশ্চাম পুডিং মডেল অনুসারে প্রত্যেকটি ইলেকট্রন সুষমভাবে ধনাত্মক চার্জে চার্জিত গোলকের কেন্দ্রের দিকে আকর্ষিত হয়।
অপর দিকে ইলেকট্রনগুলোর সমধর্মী চার্জ পরস্পরকে বিকর্ষণ করে। ফলে ইলেকট্রনগুলো ধনাত্মক চার্জে চার্জিত গোলকের অভ্যন্ড্ররে নিজেদেরকে এমন ভাবে সজ্জিত করে যেন আকর্ষণ বল এবং বিকর্ষণ বলে সমতা আসে। যখন পরমাণুকে উত্তেজিত করা হয় তখন ইলেকট্রনগুলো পরমাণুর মধ্যে অগ্রপশ্চাৎ কম্পিত হতে থাকে এবং সেকারণে অবলোহিত, দৃশ্য এবং অতিবেগুনী রশ্মি নির্গত হয়।
থমসনের পরমাণু মডেলের ব্যর্থতা :
থমসনের পরমাণু মডেলটি পরমাণু গঠনের চাহিদা পূরণে ব্যর্থ হয়েছে।
১। ইলেকট্রনের চার্জ 1.6×10-9 C এবং নির্দিষ্ট, ফলে পরমাণুতে যদি n সংখ্যক ইলেকট্রন থাকে তবে পরমাণুতে nx1.6×10″C ঋণাত্মক চার্জ আছে। অপর দিকে ধনাত্মক গোলকটি সুষম ভাবে চার্জিত। তাহলে ইলেকট্রন সংখ্যা বৃদ্ধির সাথে সাথে ধনাত্মক গোলকটি চার্জ কেন বিচ্ছিন্ন ভাবে বাড়বে তা জানা যায় না।
২। থমসনের পরমাণু মডেলে হাইড্রেজেন পরমাণু থেকে একটি মাত্র বর্ণালী রেখা পাওয়া যাবে কিন্তু পরীক্ষার মাধ্যমে দেখা গেছে হাইড্রেজেন পরমাণু থেকে একাধিক শ্রেণি বর্ণালী পাওয়া যায় এবং প্রত্যেক শ্রেণিতে একাধিক বর্ণালী রেখা থাকে।
৩। রাদারফোর্ডের আলফা কণা পরীক্ষার প্রাপ্ত ফলাফল থমসনের পরমাণু মডেলের ধারণার সাথে কোনো মিল নেই। সুতরাং, থমসনের পরমাণু মডেলের উন্নতি সাধন প্রয়োজন ।
সার-সংক্ষেপ :
ডালটনের তত্ত্বঃ
১। সকল মৌলিক পদার্থ অতি ক্ষুদ্র, অবিভাজ্য নিরেট কণার সমন্বয়ে গঠিত। কণাগুলেকে বলা হয় পরমাণু। ২। একই মৌলিক পদার্থের পরমাণুগুলো একই প্রকারের, কিন্তু বিভিন্ন মৌলিক পদার্থের পরমাণুগুলো বিভিন্ন ।
৩। একাধিক পরমাণুর রাসায়নিক মিলনে যৌগিক পরমাণু সৃষ্টি করে।
1897 সালে বিজ্ঞানীরা থমসন পরমাণু সম্পর্কে দুটি মতবাদ ব্যক্ত করেন :
১। প্রতিটি পরমাণুতে ইলেকট্রন বিদ্যমান, এবং
২। যেহেতু প্রতিটি পরমাণু বৈদ্যুতিকভাবে নিরপেক্ষ, সুতরাং এতে কিছু ধনাত্মক চার্জ আছে এবং এর চার্জ
ইলেকট্রনগুলোর ঋণাত্মক চার্জের সমান হওয়া অত্যাবশ্যক।
থমসনের পরমাণু মডেল ঃ একটি নিরেট ধনাত্মক গোলক এবং এই গোলকের মধ্যে বিক্ষিপ্তভাবে ইলেকট্রনগুলো ছড়ানো আছে ঠিক যেমন পুডিং এর মধ্যে কিসমিস ছড়ানো থাকে ।
বহুনির্বাচনী প্রশ্ন:
১। থমসনের পরমাণু মডেল অনুসারে,
i. ইলেকট্রনগুলো পরমাণুতে স্থির থাকে।
ii. সমগ্র পরমাণু জুড়েই ধনাত্মক থাকে ।
iii. পরমাণু চার্জ নিরপেক্ষ
নীচের কোনটি সঠিক?
ক. i ও ii
খ. ii ও iii
গ. i ও iii
ঘ. i, ii ও iii
২। ডালটনের পারমাণবিক তত্ত্ব অনুসারে,
i. সকল মৌলিক পদার্থ অতি সূক্ষ্ম, অবিভাজ্য নিরেট কণার সমন্বয়ে গঠিত। কণাগুলেকে পরমাণু বলা হয় ।
ii. একই মৌলিক পদার্থের পরমাণুগুলো একই প্রকারের।
iii. একাধিক পরমাণুর রাসায়নিক মিলনে যৌগিক পরমাণু সৃষ্টি করে।
নীচের কোনটি সঠিক?
ক. i ও ii
খ. ii ও iii
গ. i ও iii
ঘ. i, ii ও iii
