আজকে আমরা নিউক্লিয়াসের গঠন সম্পর্কে আলোচনা করবো। যা বাউবি এইচএসসি ২৮৭১ পদার্থ বিজ্ঞান ২য় পত্র ইউনিট ৯ নিউক্লিয় পদার্থবিজ্ঞান এর অন্তর্ভুক্ত।
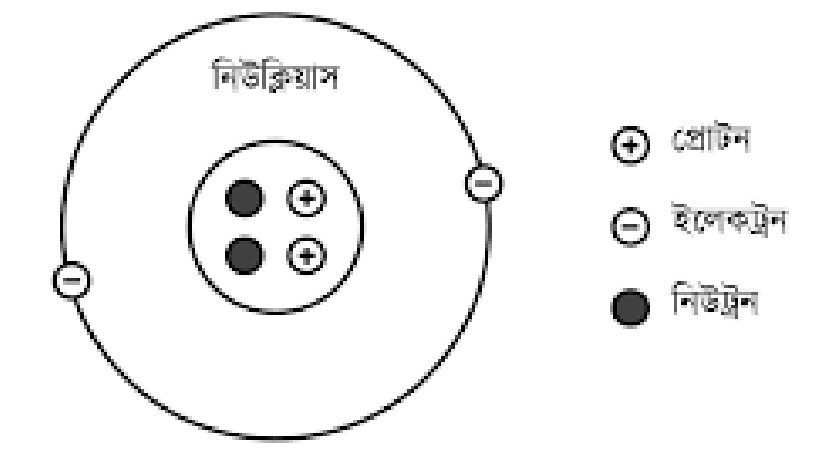
নিউক্লিয়াসের গঠন
নিউক্লিয়াসের উপাদান (Elements of Nucleus) :
রাদারফোর্ডের পরমাণু মডেল অনুযায়ী পরমাণুর সমস্ড ধনাত্মক চার্জ এর কেন্দ্রে অতি অল্প স্থান জুড়ে থাকে। একে নিউক্লিয়াস বলে। পরমাণুর প্রায় সমড় ভরই এর নিউক্লিয়াসে পুঞ্জিভূত থাকে। একটি নিউক্লিয়াসের ব্যাস 10 m ক্রমের। নিউক্লিয়াসের আয়তন পরমাণুর আয়তনের প্রায় 102 ভাগের একভাগ মাত্র ।
1932 সালে চ্যাডউইক কর্তৃক নিউট্রন কণা আবিস্কৃত হয়। নিউক্লিয়াস মূলত প্রোটন ও নিউট্রন নামক দুই প্রকার মৌলিক কণা দিয়ে গঠিত। প্রোটন ধনাত্মক চার্জগ্রড় এবং নিউট্রন তড়িৎ নিরপেক্ষ। নিউট্রন ও প্রোটনকে একত্রে নিউক্লিয়ন বলে । একমাত্র হাইড্রোজেন পরমাণুর নিউক্লিয়াসে কোনো নিউট্রন নেই, শুধু একটি প্রোটন আছে।
এখানে একটু জেনে রাখা দরকার যে, নিউক্লিয়াসের মধ্যে প্রোটন ও নিউট্রন দুটি স্থায়ী কণা হলেও মুক্ত অবস্থায় নিউট্রন স্থায়ী কণা নয়। নিজে থেকে B ক্ষয় ঘটলে প্রোটনে পরিণত হয়।
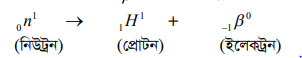
নিউট্রনের অর্ধায়ু হলো প্রায় 12 minute । এখানে আরো উলেণ্টখ্য যে, এই ক্ষয় ক্রিয়ার সাথে অ্যান্টিনিউট্রিনো নামে আরো একটি কণাও নির্গত হয় ।
প্রোটনের চার্জ, e=1.6×10-19 C
প্রোটনের ভর ইলেকট্রনের ভরের 1836 গুণ।
সুতরাং, প্রোটনের ভর, mp = 1836 x 9.11×10-31 = 1.673×10-27 kg
প্রোটনের পরীক্ষালব্ধ ব্যাসার্ধ, rp, = 1.2×10-5m
নিউট্রনের ভর ইলেকট্রনের ভরের 1839 গুণ।
সুতরাং, নিউট্রনের ভর, m, =1839×9.11×10-31 = 1.675×10-27 kg
নিউট্রনের ব্যাসার্ধ প্রোটনের পরীক্ষালব্ধ ব্যাসার্ধের সমান অর্থাৎ, rn = 1.2×10-15 m
নিউক্লিয়াস সংক্রাড় বিভিন্ন রাশি :
নিউক্লিয়াসের গঠন ও কার্যকারীতা সম্বন্ধে জানতে হলে কতকগুলো বিষয় সম্বন্ধে পরিষ্কার ধারণা রাখতে হবে। নীচে তার সংক্ষিপ্ত বিবরণ দেয়া হলো ।
১। একীভূত পারমাণবিক ভর একক (Unified atomic mass unit) :
পরমাণুর ভর এতই কম যে একে কিলোগ্রামে প্রকাশ করা হয় না। এর একক হলো একীভূত পারমাণবিক ভর একক (Unified atomic mass unit)। একে সংক্ষেপে u দিয়ে প্রকাশ করা হয়।
একটি কার্বন-12 পরমাণুর ভরের 1/12 অংশকে 1 u বলা হয় ।
আমরা জানি, 1 গ্রাম পরমাণু কার্বনের ভর = 12g
আবার যেহেতু যেকোনো মৌলের 1 গ্রাম পরমাণুতে পরমাণু সংখ্যা = অ্যাভোগাড্রো সংখ্যা = 6.023×1023
অতএব 1 গ্রাম পরমাণু কার্বনে পরমাণু সংখ্যা = 6.023×1023
সুতরাং, 6.023×1023 টি কার্বন পরমাণুর ভর = 12g
1টি কার্বন পরমাণুর ভর = 12/6.023×1023g
অতএব, 1/12টি কার্বন পরমাণুর ভর = 1/12 x 12/6.023×1023 = 1/6.023×1023 g
=1.66×10-4g =1.66×10-27kg
সুতরাং, 1u=1.66×10-27 kg
প্রোটন ও নিউট্রনের ভরকে u এককে প্রকাশ করলে,
প্রোটনের ভর =1.673×10-27 kg
তাহলে, u এককে প্রোটনের ভর = (1.673×10-27)/ (1.66 ×10-27) = 1.0078u
নিউট্রনের ভর =1.675 x 10-27 kg
তাহলে, u এককে নিউট্রনের ভর = (1.675×10-27)/ (1.66 ×10-27) = 1.0090u
১৯৬১ সালের আগ পর্যন্ত্ অক্সিজেন-১৬-এর সাথে তুলনা করে আণবিক ও পারমাণবিক স্কেলে ভর পরিমাপ করা হতো তখন তাকে পারমাণবিক ভর একক (atomic mass unit) বলা হতো এবং (amu) দিয়ে প্রকাশ করা হতো। এখনো অনেকে একীভূত পারমাণবিক ভর একককে অর্থাৎ u-কে পারমাণবিক ভর একক তথা amu দ্বারা প্রকাশ করে থাকেন।
২। ভর-শক্তির তুল্যতা (Mass Energy Equivalance) :
শক্তির অপর একটি রূপ হলো ভর। পদার্থকে শক্তিতে এবং শক্তিকে পদার্থে রূপান্ডুরিত করা সম্ভব। তাই ভর ও শক্তি পরস্পরের সমতুল্য। এইজন্যই ভর বোঝাতে শক্তির এককে এবং কখনো শক্তি বোঝাতে ভরের একক ব্যবহার করা হয় । আইন্টাইনের আপেক্ষিক তত্ত্ব থেকে ভর-শক্তির তুল্যতা নীতি পাওয়া যায় ।
কোনো পদার্থের m ভর যদি শক্তিতে রূপান্ত্রিত করা হয় তবে, আইনস্টাইনের সূত্রানুসারে, তুল্য শক্তি, E = mc2
তাহলে, 1u ভরের তুল্য শক্তি হবে, E = 1.66×10-27 ‘ x (3×108 )2
বা, E = 1.49×10-10 J
সুতরাং, 1u ভরের তুল্য শক্তি = 1.49×10- 10 J
অতএব, একটি প্রোটনের তুল্য শক্তি = 1.0078×1.49×10-10 = 1.502×10-10J
একটি নিউট্রনের শক্তি তুল্য শক্তি =1.0090×1.49 ×10 – 10 = 1.503×10- ” J -10
শক্তির একক জুল একটি বড় একক। পরমাণবিক শক্তিকে eV এককে প্রকাশ করা হয় । এক বিভব পার্থক্যের দুটি বিন্দুর এক বিন্দু থেকে অপর বিন্দুতে একটি ইলেকট্রনকে স্থানান্ত্র করতে সম্পাদিত কাজকে 1eV বলে ।
অর্থাৎ, leV = একটি ইলেকট্রনের চার্জ x 1volt
বা, 1eV=1.6×10-19c×1J/C =1.6×10-19 J
সুতরাং, 1u ভরের তুল্য শক্তি = (1.49×10-10)/( 1.6×10-19 ) = 931.2×10 eV
বা, 1u = 931.2MeV
তাহলে, একটি প্রোটনের তুল্য শক্তি =1.0078×931.2=938.6MeV
একটি নিউট্রনের তুল্য শক্তি = 1.0090×931.2 = 939.7Me
একটি ইলেকট্রনের ভর 9.11×10- 31kg = (9.11×10-31)/( 1.66×10-27) = 0.00055 u
অতএব, একটি ইলেকট্রনের তুল্য শক্তি = 0.00055 x 931.2 = 0.511Me
উদাহরণ ১ :
যদি মাটির ভরকে সম্পূর্ণরূপে শক্তিতে রূপান্ত্র করার উপায় জানা থাকতো তবে 1000 MW ক্ষমতা সম্পন্ন কোনো বিদ্যুৎ কেন্দ্রের জ্বালানী হিসাবে বছরে কত মাটির প্রয়োজন হতো বের কর ন ।
সমাধান :
1000MW = 1000 x 10৬ w
এক বছর, 1y = 365 x 86400s
সুতরাং এক বছরের জন্য প্রয়োজনীয় শক্তি, E = 1000 x 106 x 365 x86400 = 3.1536 x10 J
আমরা জানি, E = mc2
বা, m = E /c2 = (3.1536×1016)/(3×108) = 0.350kg = 350g
উ:350g
৩। নিউক্লিয়াসের ব্যাসার্ধ (Radius of Nucleus) :
আমরা দেখেছি একটি প্রোটন বা একটি নিউট্রনের ব্যাসার্ধ = 1.2×10-5m
তাহলে প্রতিটি প্রোটন বা নিউট্রনের আয়তন, V’ ==4/3πro3
কোনো নিউক্লিয়াসে প্রোটন ও নিউট্রনের সমষ্টি = ভর সংখ্যা = A
তাহলে ঐ নিউক্লিয়াসের আয়তন V =4/3πro3 A
যদি ঐ নিউক্লিয়াসের ব্যসার্ধ R হয় তবে আয়তন V =4/3πro3
সুতরাং, 4/3πR3 = 4/3πro3A
বা, R3 = ro3A
বা, R = roA1/3 ……………….(1)
উদাহরণ ২ ঃ
ইউরেনিয়াম (23592U) এর ভর সংখ্যা A = 235 । ইউরেনিয়াম নিউক্লিয়াসের ব্যাসার্ধ নির্ণয় করন।
সমাধানঃ
দেয়া আছে, A = 235
আমরা জানি, নিউক্লিয়াসের ব্যাসার্ধ, R = roA1/3 এবং ro = 1.2×105m
অতএব, ইউরেনিয়াম নিউক্লিয়াসের ব্যাসার্ধ, Ru = roA1/3 = 1.2×105 × (235)1/3 = 7.4×10-15 m
উ: 7.4 x 10-15 m
৩। নিউক্লিয়াসের ঘনত্ব (Density of Nucleus) :
নিউক্লিয়াসটি ভর M এবং আয়তন V হলে,
ঘনত্ব, P= M/ V = M/( 4/3πR3)
বা, P= M/ V = M/( 4/3πro3A) ……………….(2)
উদাহরণ ৩ ঃ
কোনো মৌলের নিউক্লিয়াসের ভর সংখ্যা 4 হলে সেই মৌলের নিউক্লিয়াসের ঘনত্ব নির্ণয় করন।
সমাধান ঃ
দেয়া আছে,
নিউক্লিয়াসটির ভর, M = A u = A×1.66×10-27 kg
নিউক্লিয়াসটির আয়তন, V = 4/3πro3A = 4/3 × π ×(1.2×105) × Am2
অতএব, নিউক্লীয় ঘনত্ব, p= M/V = (A×1.66×10-27)/ 4/3 × π ×(1.2×105) × A
বা, p = 2.3x107kg m-3
সাধারণত নিউক্লীয় ঘনত্বের মান, p=2x107kgm ধরা হয়।
উ: p=2×107kgm -3
৪। নিউক্লিয় বল (Nuclear Force) :
নিউক্লিয়াসের মধ্যে প্রোটন ও নিউট্রনগুলো তীব্র আকর্ষণ বলের প্রভাবে পরস্পরের সংযুক্ত অবস্থায় থাকে। এই বলকে নিউক্লিয় বল বলে।
নিউক্লিয় বলের বৈশিষ্ট্য :
১। নিউক্লিয় বল শুধু আকর্ষণীয় বল। এই বলের তীব্রতা মহাকর্ষ এবং তাড়িতচৌম্বক বলের চেয়ে অনেক বেশী
২। এই বল চার্জ নিরপেক্ষ । ধনাত্মক চার্জযুক্ত প্রোটন এবং চার্জহীন নিউট্রনের জন্য নিউক্লিয় বলের মান একই থাকে অর্থাৎ একই দূরত্বে প্রোটন-প্রোটন, নিউট্রন-নিউট্রন বা প্রোটন- নিউট্রন বলগুলোর মধ্যে কোনো পার্থক্য নাই ।
৩। এটি একটি স্বল্প পালণ্ঢার বল। এর পালণ্ঢা 10-4m, অর্থাৎ নিউক্লিয়াসের মধ্যে 10-4m পর্যন্ত্ দূরত্বে নিউক্লীয় বল অতি তীব্র এবং এর বাইরে এই বলের কোনো প্রভাব নেই। সুতরাং নিউক্লিয়নগুলো শুধু মাত্র তার পাশ্ববর্তী নিউক্লিয়নের সাথে আবদ্ধ থাকে দূরবর্তী নিউক্লিয়নগুলোর সাথে নয়।
৫। ভর সংখ্যা (Mass Number) :
পরমাণবিক ভর এককে কোনো মৌলের পরমাণু ভরের নিকটবর্তী পূর্ণসংখ্যাকে পরমাণুর ভর সংখ্যা বলে। সহজ ভাবে বলা যায়, নিউক্লিয়াসে নিউট্রন প্রোটন সংখ্যার যোগফলকে পরমাণুর ভর সংখ্যা। ভর সংখ্যা একটি সংখ্যা মাত্র, এর কোনো একক নাই। ভর সংখ্যাকে A দিয়ে প্রকাশ করা হয়। কোনো পরমাণুর ভর সংখ্যা প্রকাশের জন্য মৌলের প্রতীকের মাথায় বাম দিকে এই সংখ্যা লেখা হয়। যেমন, ‘H, ‘He, 2 C ….. ।
৬। পারমাণবিক সংখ্যা (Atomic Number) :
কোনো মৌলের পরমাণুর নিউক্লিয়াসে থাকা প্রোটন সংখ্যাকে ঐ মৌলের পারমাণবিক সংখ্যা বলে। একে Z দিয়ে প্রকাশ করা হয়। পারমাণবিক সংখ্যা প্রকাশের জন্য কোনো মৌলের প্রতীকের আগে ও নীচের দিকে পারমাণবিক সংখ্যাটি লেখা হয় 2X, 2X^ ) । যেমন, 12C বা Cl2 এখানে কার্বন-12 এর পারমাণবিক সংখ্যা 12।
৭। আইসোটোপ (Isotope) :
একই মৌলের একাধিক ভর সংখ্যাবিশিষ্ট পরমাণু থাকলে সেগুলিকে পরস্পরের আইসোটোপ বলে। অর্থাৎ যে সকল পরমাণুর পারমাণবিক সংখ্যা ( 2 ) সমান কিন্তু ভর সংখ্যা ( 4 ) ভিন্ন তাদেরকে আইসোটোপ বলে। নিউট্রন সংখ্যা ভিন্ন হওয়ার কারণে এদের ভর সংখ্যা ভিন্ন হয়। এদের পারমাণবিক সংখ্যা একই বলে এদের রাসায়নিক ধর্মও একই এবং পর্যায় সারণীতে এদের স্থানও একই। যেমন- কার্বনের দুটি আইসোটোপ C এবং C কারণ এদের পারমাণবিক সংখ্যা সমান (6) কিন্তু ভর সংখ্যা ভিন্ন (12) ও (13)।
৮। আইসোটোন (Isotone) :
যে সকল পরমাণুতে সমান সংখ্যক নিউট্রন থাকে, তাদের পরস্পরকে আইসোটোন বলে। যেমন- K ও Ca । K পরমাণুর নিউট্রন সংখ্যা, A – Z = 39–19 =20
পরমাণুর নিউট্রন সংখ্যা, A – Z = 40 – 20 = 20 40
৯। আইসোবার (Isober) :
যে সকল পরমাণুর ভর সংখ্যা সমান তাদেরকে বলা হয় আইসোবার। এদের ভর সংখ্যা সমান হলেও প্রোটন ও নিউট্রন সংখ্যা সমান নয়।
যেমন- 18 Ar 20 Ca |
১০। ভর ত্র“টি ও বন্ধন শক্তি (Mass Deffect and Binding Energy) :
ভর ত্র“টি ঃ
কোন নিউক্লিয়াসের ভর তার গঠনকারী প্রোটন ও নিউট্রনের ভরের যোগফল হতে কিছুটা কম হয়ে থাকে । ভরের এই পার্থক্যকে ভর-ত্র“টি বলে। একে সাধারণতঃ ∆m দিয়ে প্রকাশ করা হয়।
মনে করি কোন নিউক্লিয়াসের প্রোটন সংখ্যা Z এবং নিউট্রন সংখ্যা A – Z । যদি প্রোটন ও নিউট্রনের ভর যথাক্রমে mp এবং mn হয় তবে,
নিউক্লিয়াসের অবস্থিত নিউক্লীয়নের ভরের সমষ্টি = প্রোটনের ভর + নিউট্রনের ভর = Zmp +(A-Z)m
যদি নিউক্লিয়াসের ভর M (z,A) হয় তবে ভর ত্র“টি,
∆m = {Zmp + (A – Z)mn} – M (z.A)
বা, ∆m = Zm, +(A-Z) mg – M(z.A) ……………….(3)
বন্ধন শক্তি ঃ
প্রোটন এবং নিউট্রনগুলো যে শক্তির জন্য নিউক্লিয়াসে আবদ্ধ অবস্থায় থাকে তাকে বন্ধন শক্তি বলে। একে সাধারণতঃ ∆E দিয়ে প্রকাশ করা হয়।
প্রোটন এবং নিউট্রন যখন সম্পূর্ণরূপে আলাদা ভাবে থাকে এদের ভর-শক্তি বলতে শুধু ভরের সমষ্টি বোঝায়। কিন্তু তারাই যখন নিউক্লিয়াস গঠন করে তখন সেই নিউক্লিয়াসের ভর ও বন্ধন শক্তি দুই থাকে। সুতরাং ভরশক্তি নিত্যতা সূত্রানুসারে,
নিউক্লিয়াসের অবস্থিত প্রোটন ও নিউট্রনের ভরের সমষ্টি x c2 = নিউক্লিয়াসের ভর x c2 + বন্ধন শক্তি
সুতরাং, [Zmp +(A-Z)mn]c2 = M (z.A)c2 + ∆E
সুতরাং, নিউক্লিয়াসের বন্ধন শক্তি, ∆E = [Zmp + (A – Z)mn – M(z.A)]c2 ……………….(4)
বা, ∆E = mc2
আবার, যেহেতু নিউক্লিয়াসে A সংখ্যক নিউক্লিয়ন আছে, সেহেতু নিউক্লিয়াসের মধ্যে নিউক্লিয়নের গড় বন্ধন শক্তি,
∆E/A = [Zmp +(A-Z)mn – M (z.A) c2/A = ∆m/Ac2 ……………….(5)
উদাহরণ ৪ :
হিলিয়াম নিউক্লিয়াসের ভর 4.0015u, প্রোটনের ও নিউট্রনের ভর যথাক্রমে 1.0073u এবং 1.0087u হয় তবে হিলিয়াম নিউক্লিয়াসের নিউক্লিয়নের গড় বন্ধন শক্তি কত হবে?
সমাধানঃ
দেয়া আছে, M = 4.0015u, mp = 1.0073um = 1.0087u,
হিলিয়াম নিউক্লিয়াসের Z = 2 এবং A= 4, ΔΕZ = ?
আমরা জানি, ভর ত্র“টি, Δm|=[Zmp + (A – Z)mn]-M (z.A)
হিলিয়াম নিউক্লিয়াসের ক্ষেত্রে, Δm = [2mp +(4-2)mn]—M (2.4) ,
মান বসালে, Δm=[2×1.0073+2×1.0087] -4.0015 = 4.0320-4.0015 = 0.305 u
হিলিয়াম নিউক্লিয়াসের বন্ধন শক্তি, ΔE = Δmc² = 0.305×931.2MeV = 284016MeV
অতএব, হিলিয়াম নিউক্লিয়াসের নিউক্লিয়নের গড় বন্ধন শক্তি, ΔE/4 = 284016/4 = 7.1004MeV
উ :7.1004MeV
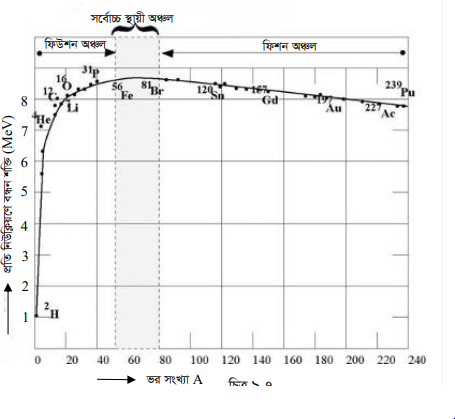
লেখচিত্রে প্রতি নিউক্লিয়ণে বন্ধন শক্তি বনাম নিউক্লিয়ন সংখ্যা দেখানো হলো। যে সব নিউক্লিয়নে বন্ধন শক্তি যত বেশী অর্থাৎ যত নিউক্লিয়নে বন্ধন দৃঢ় তাদের স্থায়িত্ব তত বেশী, অর্থাৎ তাকে ভাঙ্গতে তত বেশী শক্তি প্রয়োগ করতে হয়। (৯.৭) নং লেখচিত্রে থেকে দেখা যায় যে সব নিউক্লিয়াসের মধ্যে প্রতিটি নিউক্লিয়নে গড় বন্ধন শক্তি 8MeV এ কাছাকাছি হলে নিউক্লিয়াসের স্থায়িত্ব বাড়ে। নিউক্লিয়াসকে একটি তরল বিন্দুর সঙ্গে তুলনা করলে বিষয়টি ভালো বোঝা যায়।
যেমন তরলের ক্ষুদ্র ক্ষুদ্র বিন্দুর একত্রে মিলিত হয়ে একটি বড় বিন্দুতে পরিনত হবার প্রবণতা দেখা যায়, অপর দিকে খুব বড় বিন্দু ভেঙ্গে যাওয়ার প্রবণতা থাকে। তেমনি Z = 200 উপরে নিউক্লিয়াসগুলোর ভেঙ্গে যাবার প্রবণতা বেশী এবং Z = 20 নীচের নিউক্লিয়াসগুলোর মিলিত হবার প্রবণতা থাকে । প্রতি নিউক্লিয়ণে বন্ধন শক্তি (MeV)
সার-সংক্ষেপ :
নিউক্লিয়াসের উপাদান ঃ
নিউক্লিয়াস মূলত প্রোটন ও নিউট্রন নামক দুই প্রকার মৌলিক কণা দিয়ে গঠিত।
একীভূত পরমাণবিক ভর একক (u) ঃ
একটি কার্বন-12 পরমাণুর ভরের অংশকে 1 u বলা হয়। ১৯৬১ সালের আগ পর্যন্ত্ অক্সিজেন 16-এর সাথে তুলনা করে আণবিক ও পারমাণবিক স্কেলে ভর প্রকাশ করা হতো, তখন তাকে কেবল পারমাণবিক ভর একক (atomoic mass unit) বলা হতো। এবং amu দিয়ে প্রকাশ করা হতো। এখনো অনেকে একীভূত পারমাণবিক ভর একককে অর্থাৎ u-কে পারমাণবিক ভর একক তথা ‘amu’ দিয়ে প্রকাশ করে থাকেন । 1u বা (1amu) = 1.66×10-27kg
ভর-শক্তির তুল্যতা ঃ
শক্তির অপর একটি রূপ হলো ভর। পদার্থকে শক্তিতে এবং শক্তিকে পদার্থে রূপান্ডুরিত করা সম্ভব। তাই ভর ও শক্তি পরস্পরের সমতুল্য। এইজন্যই ভর বোঝাতে শক্তির এককে এবং কখনো শক্তি বোঝাতে ভরের একক ব্যবহার করা হয়।
আইনস্টাইনের সূত্রানুসারে, তুল্য শক্তি, E = mc2
1u বা 1amu বা ভরের তুল্য শক্তি = 1.49×10-10J
শক্তি একক জুল একটি বড় একক। পরমাণবিক শক্তিকে eV একককে প্রকাশ করা হয়।
বা, 1U বা 1amu = 931.2MeV
নিউক্লিয়াসের ব্যাসার্ধ ঃ
R=r43 = 1.2×10-m
নিউক্লিয়াসের ঘনত্ব :
p=2×107kgm3
নিউক্লীয় বল ঃ
নিউক্লিয়াসের মধ্যে প্রোটন ও নিউট্রনগুলো অথাৎ নিউক্লিয়ণগুলো তীব্র আকর্ষণ বলের প্রভাবে পরস্পরের সংযুক্ত অবস্থায় থাকে। এই বলকে নিউক্লীয় বল বলে।
আইসোবার ঃ
যে সকল পরমাণুর ভর সংখ্যা সমান তাদেরকে বলা হয় আইসোবার। এদের ভর সংখ্যা সমান হলেও পৃথকভাবে প্রোটন ও নিউট্রন সংখ্যা সমান নয়।
ভর ত্র“টি ঃ
কোন নিউক্লিয়াসের ভর তার গঠনকারী প্রোটন ও নিউট্রনের ভরের যোগফল হতে কিছুটা কম হয়ে থাকে। ভরের এই পার্থক্যকে ভর-ত্র“টি বলে। একে সাধারণতঃ Am দিয়ে প্রকাশ করা হয়।
Δm = {Zmp + (A – Z)mn) – M(z.A) ]c2 = Δmc2
বন্ধন শক্তি ঃ
প্রোটন এবং নিউট্রনগুলো যে শক্তির জন্য নিউক্লিয়াসে আবদ্ধ অবস্থায় থাকে তাকে বন্ধন শক্তি বলে। একে সাধারণতঃ AE দিয়ে প্রকাশ করা হয়।
ΔE =[Zmp + (A – Z)mn) – M(z.A) ]c2 = Δmc2
বহুনির্বাচনী প্রশ্নঃ
১। বোরের হাইড্রোজেন পরমাণু মডেলে একটি ইলেকট্রন প্রোটনের চারদিকে অনির্দিষ্ট কাল ধরে ঘুরতে পারে যদি ইহার
পথ হয়-
ক. যে কোনে ব্যাসার্ধের বৃত্ত
খ. ক্রমহ্রাসমান ব্যাসার্ধের বৃত্ত
গ. উপবৃত্তাকার
ঘ. অনুমোদিত ব্যাসার্ধের বৃত্ত
২। বোরের তত্ত্বানুযায়ী হাইড্রোজেনের n তম কক্ষপথে ইলেকট্রনের গতিশক্তি ও মোটশক্তির অনুপাত
ক. – 1
খ. 1
গ. 2
ঘ. -2
